Aprovizionarea farmaciilor cu medicamente sigure este vitală pentru sănătatea publică. Începând cu data de 9 februarie 2019 va intra în vigoare Sistemul European de Verificare a Medicamentelor, moment în care medicamentele care se vor comercializa pe piața UE vor avea ambalajele inscripționate cu elemente de siguranță. Tot de la acea dată, medicamentele eliberate pe bază de prescripție medicală, dar și o parte dintre medicamentele OTC (Over the Counter), comercializate fără rețetă, nu vor mai putea fi desfăcute din ambalaj și eliberate fracționat, adică la bucată. În România s-a constituit Organizația de Serializare a Medicamentelor (OSMR), care supraveghează buna implementare, la noi în țară, a acestui sistem. Dr. Laurențiu Mihai, Directorul General al OSMR, a oferit mai multe detalii despre ce presupune acest proces și care sunt pașii de urmat.
Procesul de implementare a Sistemului European de Verificare a Medicamentelor a intrat în linie dreaptă și în România. Care sunt cele mai mari provocări ale industriei farmaceutice în ceea ce privește eforturile de implementare a serializării medicamentelor?
O implementare eficientă în România a Sistemului European de Verificare a Medicamentelor depinde, în mare măsură, de cooperarea tuturor părților interesate, incluzând aici autorități, companiile farmaceutice, deținătorii de autorizație de punere pe piață, distribuitorii, farmaciile, spitalele și furnizorii de soluții IT.
Reprezentanții industriei farmaceutice au un rol deosebit de important, în primul rând prin responsabilitatea financiară care le-a fost atribuită în crearea sistemului european și a sistemelor naționale de verificare. Achiziționarea echipamentelor necesare aplicării elementelor de siguranță pe pachetele individuale de medicamente revine, de asemenea, în sarcina acestora. Totodată, ei vor fi direct răspunzători pentru schimbările necesare în lanțul de producție al medicamentelor, atenția fiind plasată pe găsirea unei soluții versatile de serializare care să genereze, să transfere și să securizeze datele de serializare, scopul final fiind acela de a elimina medicamentele falsificate din lanțul legal și de a asigura siguranță pacientului.
Având în vedere că, în mai puțin de 9 luni, Directiva privind combaterea Medicamentelor Falsificate intră în vigoare, este nevoie de un efort concentrat pentru a putea pune la dispoziția pacienților, la timp, medicamente care să respecte reglementările impuse de UE.
Revenind la întrebarea dumneavoastră, multe sunt dificultățile ce ne stau în față dar, personal, cred că cele mai mari provocări, oarecum similar cu situația din celelalte State Membre, sunt două: pentru industrie asigurarea finanțării efortului de implementare, iar pentru autorități adaptarea cadrului național de reglementare la noile cerințe.
Ce presupune, concret, activitatea de implementare?
Pentru a fi în concordanță cu Directiva privind combaterea Medicamentelor Falsificate, fiecare țară europeană introduce un Sistem de Verificare a Medicamentelor, ce va fi implementat și administrat de către o organizație non-profit, non-guvernamentală înființată și finanțată de către producătorii de medicamente. Scopul acestui Sistem este să funcționeze ca o platformă unde toți actorii interesați, de la producător la distribuitor, farmacie sau spital, să poată verifica autenticitatea medicamentelor, verificând identificatorul unic al fiecărui produs. Sistemul local va fi conectat la un sistem european, Eu-Hub, ce va integra și centraliza toate datele și informațiile de la nivelul Uniunii Europene.
Detalii despre aceasta, ca și despre orice alt aspect legat de implementarea în România a Sistemului Național de Verificare a Medicamentelor pot fi găsite pe https://osmr.ro.
Cât de avansate sunt demersurile privind serializarea medicamentelor?
Având în vedere faptul că serializarea medicamentelor cade în responsabilitatea producătorilor de medicamente și că aceștia au mai puțin de un an până când Directiva privind combaterea Medicamentelor Falsificate intră în vigoare, din datele noastre rezultă că majoritatea companiilor farmaceutice au început deja să își organizeze liniile de producție.
Cum se face pregătirea pieței, a celor care vor folosi acest sistem? Există o clarificare a regulilor naționale?
În cadrul planificării generale a implementării proiectului este definită o secțiune de Pilot Național, în care sunt definite cerințe și coordonate care să îndrume România în definirea acestei faze. Participanții la acest Pilot Național sunt reprezentanți ai companiilor farmaceutice, ai furnizorilor de soluții IT, ai farmaciilor și ai autorităților. Împreună, participanții vor selecta candidați cu care să se deruleze Pilotul, urmând ca după perioada stabilită să se realizeze un raport cu toate datele tehnice și operaționale din care se vor putea trage concluzii relevante, referitoare atât la reglementarea legislației cât și la specificații privind implementarea propriu-zisă.
Sunt pregătiți actorii din sistem, farmacii, spitale să implementeze acest sistem?
În 9 februarie 2018 a fost demarat oficial în România procesul de implementare a Sistemului European de Verificare a Medicamentelor, urmând ca acesta să devină operațional în toate țările din Uniunea Europeană începând cu 9 februarie 2019. La acest eveniment au fost invitate toate persoanele interesate, de la producător la distribuitor, la farmacie sau spital, putând să beneficieze de informații direct de la reprezentanți EMVO (European Medicines Verification Organisation) și ai Autorităților din România.
În același timp, este pentru prima dată în istoria UE când implementarea unei Directive cade nu în sarcina autorităților Statelor Membre ci a unei entități private. Tot procesul de implementare este în întregime nou și pe măsură ce înaintăm apar noi situații neprevăzute. Pentru a fi continuu la curent cu fazele implementării invităm pe toți cei interesați să acceseze https://osmr.ro.
De când se va introduce noul ambalaj? Care vor fi caracteristicile de siguranță de pe ambalaj?
Începând cu data de 9 februarie 2019 medicamentele vor putea fi puse în circulație pe teritoriul Uniunii Europene și al Spațiului Economic European, inclusiv pe piața din România, numai dacă respectă noile reguli de securitate, medicamentele produse până la acea dată urmând a-și urma traseul firesc, până la expirare, conform reglementărilor legale în vigoare. Caracteristicile de siguranță constau în două elemente plasate pe ambalajul unui medicament: un identificator unic, imprimat pe ambalaj sub forma unui cod de bare bidimensional, care va permite identificarea și verificarea autenticității unui pachet individual de medicamente, și un dispozitiv de protecție împotriva modificărilor ilicite, care permite verificarea integrității pachetului respectiv.
La nivel mondial se estimează că aproximativ 10 % din numărul total de medicamente ce se regăsesc pe piață sunt contrafăcute. Și numărul medicamentelor falsificate, detectate în Uniunea Europeană, a crescut alarmant. Potrivit raportului Oficiului Uniunii Europene pentru Proprietatea Intelectuală (EUIPO), dat publicității în anul 2016, valoarea medicamentelor contrafăcute reprezintă 4,4 % din vânzările legale din sectorul farmaceutic din Europa. Aceste pierderi din vânzări înseamnă, potrivit datelor din raport, și pierderea a aproximativ 38.000 de locuri de muncă. Totodată, declinul activității economice legale se reflectă și într-un minus de 1,7 miliarde de euro pe an în veniturile publice din UE, potrivit raportului care a luat în considerare impozitele pe veniturile gospodăriilor, contribuțiile de asigurări sociale și impozitele pe profit.
Medicamentele contrafăcute reprezintă o problemă serioasă pentru industria farmaceutică și sănătatea publică. Directiva 2011/62/UE a Parlamentului European și a Consiliului din 8 iunie 2011 de modificare a Directivei 2001/83/CE de instituire a unui cod comunitar cu privire la medicamentele de uz uman în ceea ce privește prevenirea pătrunderii medicamentelor falsificate în lanțul legal de aprovizionare conține prevederi îmbunătățite pentru evitarea pătrunderii medicamentelor contrafăcute în lanțurile legale de distribuție. Medicamentele pe bază de prescripție trebuie să aibă dispozitive de securitate, care să permită verificarea autenticității lor. Aceste dispozitive de securitate pot fi utilizate și pentru unele medicamente ce nu necesită prescripție medicală, dar comportă anumite riscuri. În anul 2016 a fost adoptat Regulamentul delegat al Uniunii Europene 161 din 9 februarie 2016, care stabilește norme detaliate pentru elementele de siguranță care apar pe ambalajul medicamentelor de uz uman.
La nivelul României s-a constituit Organizația de Serializare a Medicamentelor din care fac parte Asociația Română a Producătorilor Internaționali de Medicamente, Asociația Producătorilor de Medicamente Generice din România, Asociația Distribuitorilor și Retailerilor Farmaceutici din România, Asociația Distribuitorilor Europeni de Medicamente din România și Colegiul Farmaciștilor din România.
de Arina TOTH
Citește și:
Antreprenorul american Emmett King intră în Boardul Cluj International Committee
Businessmanul a administrat companii de securitate cibernetică, inteligență artificială, telemedicină, dezvoltare de software și hardware, consultanță și training.…
14 iulie 2025
Revoluție pe șine în Oradea: încă un tramvai nou produs de Astra Vagoane Călători SA
Al doilea tramvai nou a ajuns la Oradea: parte dintr-un lot de 9 vehicule moderne pentru transportul public.…
14 iulie 2025
Ziua Națională a Contabilului Român 2025: De la cifre la smart accounting
Digitalizarea aduce multe beneficii, dar și multe provocări pentru profesia de contabil și expert contabil. Ziua Națională a…
14 iulie 2025
Universitatea de Medicină și Farmacie Cluj, magnet de studenți
Numărul candidaților la admiterea în instituția clujeană de învățământ superior a crescut, în 2025, cu 660 față de…
14 iulie 2025
Maramureșul trece la nivelul următor: investitori mari în parcurile industriale
Administratorul parcurilor de specializare inteligentă (PSI) din județ a lăsat în urmă promovarea locală sau regională: o extinde…
14 iulie 2025
Operatorul Lee Coper, Kenvelo și Timeout a intrat în insolvență
Montecristo Retail, distribuitor național cu unități de vânzare în județele Cluj, Bihor, Sibiu și Brașov, va recurge la…
14 iulie 2025
Iulius Mall Cluj – experiența care fidelizează. Lider pe piața locală
Un studiu realizat de agenţia MKOR în luna mai 2025, la cererea companiei IULIUS, confirmă atractivitatea Iulius Mall…
14 iulie 2025
INVL cumpără fabricile Pehart cu credit de 150 milioane €
Tranzacția cu Abris Capital s-a realizat cu ajutorul unui împrumut sindicalizat de la International Finance Corporation, Banca Transilvania…
14 iulie 2025
Investiții
Revoluție pe șine în Oradea: încă un tramvai nou produs de Astra Vagoane Călători SA
Al doilea tramvai nou a ajuns la Oradea: parte dintr-un lot de 9 vehicule moderne pentru transportul public.…
14 iulie 2025
Maramureșul trece la nivelul următor: investitori mari în parcurile industriale
Administratorul parcurilor de specializare inteligentă (PSI) din județ a lăsat în urmă promovarea locală sau regională: o extinde…
14 iulie 2025
Iulius Mall Cluj – experiența care fidelizează. Lider pe piața locală
Un studiu realizat de agenţia MKOR în luna mai 2025, la cererea companiei IULIUS, confirmă atractivitatea Iulius Mall…
14 iulie 2025
Top 25 de companii din Transilvania și Banat în funcție de cifra de afaceri
Primele 25 de companii din regiunile de dezvoltare Vest, Nord – Vest și Centru au o cifră de…
11 iulie 2025
Când va fi gata construcția celui mai mare aquapark din Nord – Vestul României
Cel mai mare aquapark din Nord – Vestul țării se va construi între stațiunile Băile Felix și Băile…
11 iulie 2025
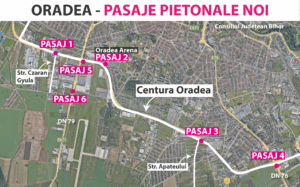
Opt oferte pentru construirea pasajelor pietonale subterane de pe Centura Oradea
Interes crescut din partea firmelor de construcții pentru una dintre cele mai importante investiții în infrastructura pietonală a…
10 iulie 2025
Oportunități de investiții în Bihor: licitații deschise pentru PSI în cinci orașe
Agenția de Dezvoltare Locală Oradea (ADLO) a demarat procesul de licitație publică pentru concesionarea de parcele în cele…
10 iulie 2025
inVest organizează la Timișoara un Speed Beer-a-thon
Evenimentul are loc în această seară la CoWork Timișoara, cu începere de la ora 18. Sunt așteptați antreprenori…
10 iulie 2025
Infrastructură
Revoluție pe șine în Oradea: încă un tramvai nou produs de Astra Vagoane Călători SA
Al doilea tramvai nou a ajuns la Oradea: parte dintr-un lot de 9 vehicule moderne pentru transportul public.…
14 iulie 2025
13 ani pentru primul drum expres de Cluj
Cea dintâi șosea cu acest regim din județ, DEx 4, a devenit funcțională, însă fără soluționarea optimă a…
10 iulie 2025
Opt oferte pentru construirea pasajelor pietonale subterane de pe Centura Oradea
Interes crescut din partea firmelor de construcții pentru una dintre cele mai importante investiții în infrastructura pietonală a…
10 iulie 2025
Oportunități de investiții în Bihor: licitații deschise pentru PSI în cinci orașe
Agenția de Dezvoltare Locală Oradea (ADLO) a demarat procesul de licitație publică pentru concesionarea de parcele în cele…
10 iulie 2025
ARL Cluj montează grinzile de la Pasajul Italsofa
Administrația județeană susține că nu se lucrează concomitent și la Pasajul Văcarilor din Baia Mare pentru a nu…
9 iulie 2025
Pasajul Oșorhei: Începe turnarea betonului pe cel mai aglomerat drum din Bihor
Pas important în construcția unuia dintre cele mai așteptate proiecte de infrastructură din județul Bihor. Miercuri, 9 iulie…
9 iulie 2025
Memorandum de Colaborare între Hainan (China) și Zona Liberă Curtici-Arad
Biroul de Afaceri Externe al Provinciei Hainan (China) și Zona Liberă Curtici-Arad au semnat, miercuri, 9 iulie 2025,…
9 iulie 2025
Pod peste continente: Arad și Hainan sărbătoresc 25 de ani de înfrățire
Un sfert de secol de cooperare, schimb de bune practici și solidaritate reciprocă. Relația dintre Județul Arad și…
9 iulie 2025
Turism
Băile Cojocna, „resuscitate” în stațiune balneară
Baza de tratament subdimensionată necesită intervenții consistente, restaurantul este utilizat doar parțial, iar clădirea hotelului a funcționat foarte…
11 iulie 2025
7 lucruri care nu trebuie să lipsească din bagajul pentru plajă
Sosirea sezonului cald marchează momentul perfect pentru planuri la mare, zile relaxante sub soare și ieșiri pe nisip.…
11 iulie 2025
Atmosferă istorică la Timișoara: Festivalul Medieval al Castelului Huniade te poartă înapoi în timp, printre cavaleri și domnițe
Festivalul Medieval al Castelului Huniade are loc între 11–13 iulie și aduce în prim plan cavaleri, ateliere, muzică…
11 iulie 2025
Când va fi gata construcția celui mai mare aquapark din Nord – Vestul României
Cel mai mare aquapark din Nord – Vestul țării se va construi între stațiunile Băile Felix și Băile…
11 iulie 2025
Andreea Marinescu: „Hotelul modern trebuie să fie un spațiu viu, sustenabil și relevant pentru comunitate”
“Ne dorim să fim mai mult decât o destinație de cazare. Vrem să fim o alegere conștientă, un…
10 iulie 2025
Târgul de Turism al României – Ediția de Toamnă
Cel mai mare târg de turism are loc la ROMEXPO! După succesul remarcabil al ediției din februarie, care…
8 iulie 2025
Megaproiect de 25 milioane € la Salina Turda. “Să evităm un dezastru ca la Praid”
Municipalitatea cere statului bani pentru lucrări urgente de punere în siguranță și consolidare pentru obiectivul care atrage anual…
7 iulie 2025
Peste 260.000 de pasageri în semestruI I 2025 și noi rute ce deschid orizonturi
În primele șase luni ale anului 2025, Aeroportul Internațional Sibiu a fost alegerea a 260.234 de călători, față…
7 iulie 2025
Educație
Ziua Națională a Contabilului Român 2025: De la cifre la smart accounting
Digitalizarea aduce multe beneficii, dar și multe provocări pentru profesia de contabil și expert contabil. Ziua Națională a…
14 iulie 2025
Universitatea de Medicină și Farmacie Cluj, magnet de studenți
Numărul candidaților la admiterea în instituția clujeană de învățământ superior a crescut, în 2025, cu 660 față de…
14 iulie 2025
Roboții orădeni Afrodita și Jon Bot Jovi au făcut furori la YOKOZUNA Robot Yūshō
Echipele TOR și DARK din cadrul Robotics Club Oradea al Facultății de Inginerie Managerială și Tehnologică – rezultate…
14 iulie 2025
Topul înscrierilor timpurii la UBB: 1. Psihologie, 2. Drept, 3. Economice
Numărul candidaților din prima zi a admiterii la facultățile universității din Cluj este aproape dublu față de anul…
11 iulie 2025
Universitatea Babeș-Bolyai va sprijini tinerii cercetători în DeepTech
Instituția clujeană de învățământ superior participă la un proiect finanțat prin programul Horizon Europe al Uniunii Europene (UE).…
8 iulie 2025
Mai puțini șomeri în județul Bihor: cifrele AJOFM Bihor arată o tendință pozitivă
La sfârșitul lunii iunie 2025, rata șomajului în județul Bihor a coborât la 2,05%, potrivit datelor centralizate de…
7 iulie 2025
EU GREEN aduce inovația sustenabilă la Universitatea din Oradea
Timp de cinci zile, între 7 și 11 iulie 2025, Universitatea din Oradea este gazda întâlnirilor directe din…
7 iulie 2025
Conexiuni și lecții de business: eveniment special la Incubatorul CRESC Oradea Mare
Incubatorul de Afaceri Cresc Oradea Mare a reunit joi, 3 iulie 2025, reprezentanții unora dintre companiile reprezentative din…
5 iulie 2025